宣武医院卢洁教授团队与东南大学陈阳教授团队在《IEEE TMI》发文构建缺血性卒中早期识别的人工智能模型
7月,首都医科大学宣武医院卢洁教授团队与东南大学陈阳教授团队合作,在人工智能医学影像领域顶级期刊《IEEE Transactions on Medical Imaging》(5年影响因子为11.299分,中科院1区Top)上在线发表题为“Pathological Asymmetry-Guided Progressive Learning for Acute Ischemic Stroke Infarct Segmentation”的论文。东南大学博士研究生孙佳瑞与首都医科大学宣武医院放射与核医学科硕士研究生李秋璇为本文共同第一作者,陈阳教授与卢洁教授为共同通讯作者。

《中国脑卒中防治报告(2023)》显示,我国40岁及以上人群脑卒中现患人数已达1242万,其中缺血性卒中患者约占80%。缺血性卒中还具有高复发率、高致残率、高死亡率等特点,对国家与国民造成了沉重负担。因此,缺血性卒中的早期筛查、精准诊断、疗效评估与预后预测显得尤为重要。人工智能通过学习影像数据、自动提取信息,能够减少主观因素带来的偏倚和误差,提供更为准确和客观的患者状态评估。近年来,人工智能在脑卒中影像诊断领域得到了快速发展,显著提升了临床诊疗水平。CT是急性缺血性卒中的首选影像学检查,CT平扫和CT灌注均可用于评估缺血灶。CT平扫具有快速、无创的特点,传统上常使用定性方法评估缺血程度。尽管CT灌注可以提供更详细的信息,但由于其有创特性和阈值法可能高估缺血灶体积,目前仍存在争议。因此,使用CT平扫进行无创、快速的缺血灶评估是最优的诊疗方式。然而,CT平扫数据的精度较低,早期缺血灶的细微变化是目前人工智能模型构建中的挑战。
近年来,深度学习模型在急性缺血性卒中分割中展现出了巨大的潜力。这些模型大多利用人脑的对称性,整合相关特征以弥补患侧脑组织影像信息的缺失。然而,急性缺血性卒中患者脑组织对称性会发生一定改变,这会潜在影响分割结果的准确性。该研究采用了公共数据集AISD和宣武医院数据集中的平扫CT与DWI数据,通过智能学习影像诊断步骤,建立了基于病理不对称引导的渐进学习模型(PAPL)。该模型在缺血脑组织的病理层面上全面而充分地捕捉信息,从而实现了对早期缺血灶的准确分割。

图1:PAPL模型构建思路图。(a)早期急性缺血性卒中患者脑组织缺血区域改变不明显;(b)目前现有人工智能方法的不足:常忽略了病理状态下脑组织对称性改变对分割效能的影响(c)在表征层面区分不对称以达到准确分割
PAPL模型包含三个渐进式学习阶段:知识储备阶段、正式学习阶段和最终改进阶段。在知识储备阶段,模型通过积累分割任务的影像特征,并构建对比学习任务,提升对病理不对称的辨别能力。在正式学习阶段,模型利用学习到的影像特征,进行高效的端到端训练,其中设计的特征补偿模块利用影像数据中相邻层的解剖相似性,帮助汇总丰富的解剖背景信息。最终改进阶段对前一阶段的缺血灶预测结果进行改进,提出了感知改进策略,通过双边差异比较和自适应区域收缩来纠正错误的梗死区域分割。

图2:PAPL模型的三个渐进式学习阶段。(1)知识储备阶段;(2)正式学习阶段;(3)最终改进阶段
PAPL模型与U-Net、U-Net++、TransU-Net、ISP-Net、X-Net、CLCI-Net等模型进一步比较,结果显示PAPL模型效能明显优于这些模型。AISD数据集的戴斯相似系数、Jaccard相似系数、平均对称表面距离、精确度、敏感度分别为0.5468、0.4080、4.7404、0.6985、0.5154。宣武医院数据集的戴斯相似系数、Jaccard相似系数、平均对称表面距离、精确度、敏感度分别为0.4899、0.3541、4.6173、0.6204、0.4923。在分割体积小于70ml的缺血灶时,PAPL模型相较于U-Net、CENet、U-Net++ 、TransU-Net模型表现良好,戴斯相似系数、Jaccard相似系数、平均对称表面距离、精确度分别为0.5081、0.3700、5.4625、0.6819。PAPL模型能够在缺血脑组织的病理层面上全面、充分捕捉信息,最终达到早期缺血灶的准确分割。

图3:AISD数据集中可视化比较多模型间的分割效能。PAPL模型对缺血区域的勾勒最为精准
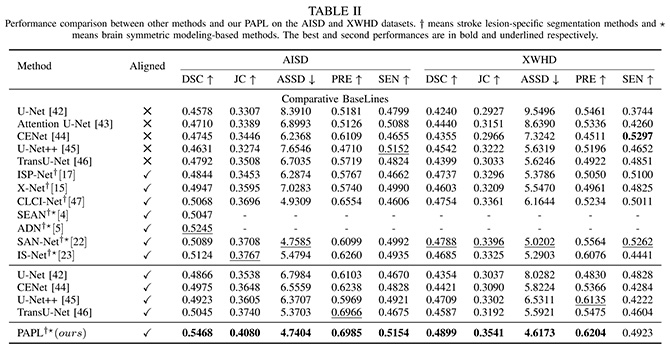
表1:PAPL模型在AISD和宣武医院数据集中与其他模型的性能比较
PAPL模型通过渐进式学习模式,克服了以往卷积神经网络的潜在局限,能够实现对缺血灶的精确、敏感和定量评估,从而进一步提升临床诊疗的效果。